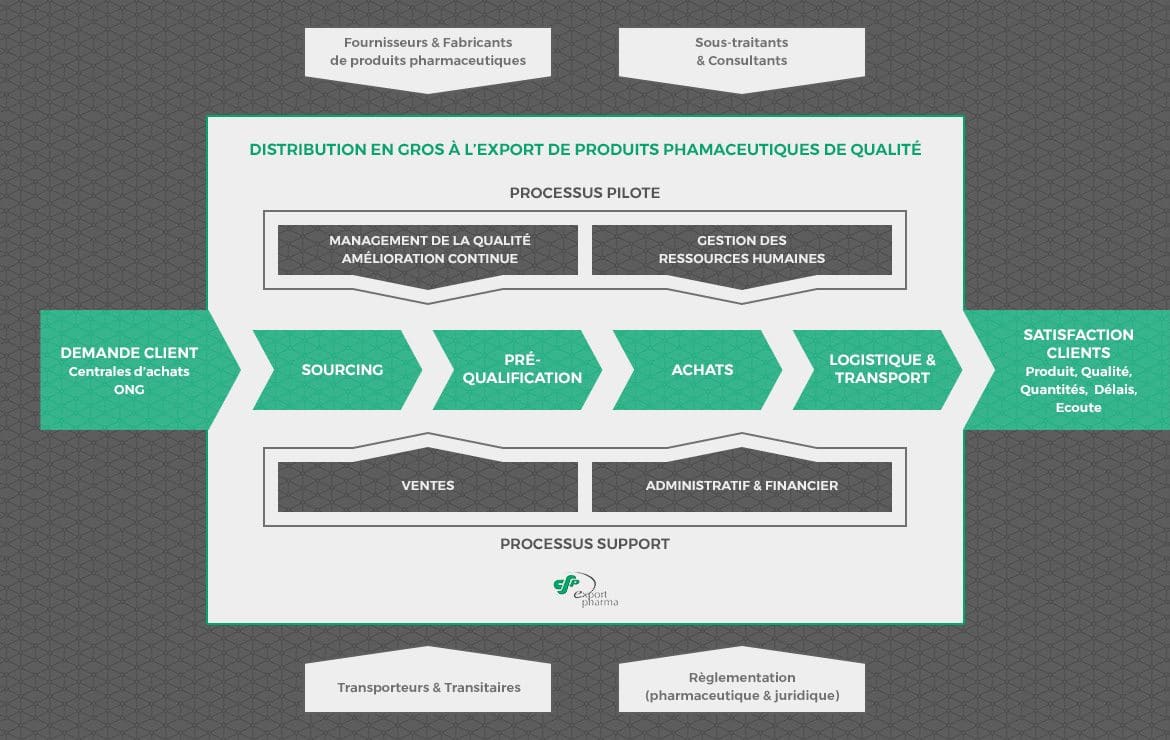
Le système qualité mis en place à partir des Bonnes Pratiques de Distribution, du système modèle d’assurance qualité pour les agences d’approvisionnement et de la norme ISO 9001 permet la maîtrise de toutes les activités ayant un impact sur la qualité avec pour objectif la conformité permanente des produits et des services, la satisfaction du client et le respect de la réglementation.
Afin de répondre à ces objectifs, la société CSEP est structurée en 4 processus de réalisation (sourcing, préqualification, achats et logistique / transport), et pilotée par le management de la qualité, l’amélioration continue et les ressources humaines. Les processus supports indispensables à l’activité de la société sont les processus ventes et administratif et financier.
Chaque année, une évaluation formalisée de l’état et de l’adéquation du système qualité par rapport à la politique qualité et à ses objectifs est effectuée par la direction.
Les indicateurs généraux liés au système qualité et les indicateurs spécifiques à chacun des processus sont évalués dans un but d’amélioration continue.
Évaluation des fournisseurs
Après l’étape de sourcing, les fournisseurs de produits pharmaceutiques sont tous évalués par le département qualité selon différentes méthodes en fonction du risque :
– Certificats de Bonnes Pratiques de Fabrication
– Analyse documentaire
– Audits des sites de fabrication et évaluation des plans d’actions correctives et préventives
La décision finale de préqualification du fournisseur est donnée par un comité dont le fonctionnement garantit l’indépendance des décisions. Les performances fournisseurs ainsi préqualifiés sont évaluées à fréquence régulière et définie.
Evaluation des produits
La demande de documentation relative aux produits pharmaceutiques est ensuite faite aux différents fournisseurs pré qualifiés. Le département qualité évalue les certificats d’analyses (matières premières et produits finis), les spécifications (matières premières et produits finis), les études de stabilité, les preuves d’efficacité (selon la forme galénique) et les notices et étiquetages selon des modes opératoires prédéfinis.
Les résultats de l’évaluation des documents sont intégrés à une base de données de pré qualification des produits pharmaceutiques. Cette base de données développée par la société CSEP permet d’attribuer un score à chaque produit pharmaceutique intégré à cet outil. Le score tient compte de l’ensemble des critères qualité évalués et pondérés selon le risque.
Une politique de contrôle qualité est mise en place en fonction du score attribué à chacun des produits et du niveau de risque des fabricants.
